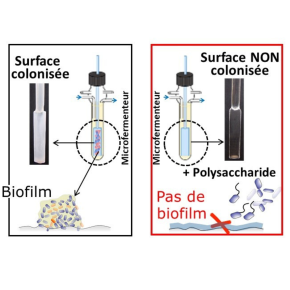
Les propriétés physicochimiques de polysaccharides bactériens anti-biofilm dévoilées
Les bactéries produisent à leur surface des capsules constituées de polysaccharides1 de haut poids moléculaire possédant une activité anti-biofilm jusqu’alors mal comprise. Des équipes de l’Institut Pasteur, du CNRS-INSU et de Sanofi (voir encadré), ont identifié certaines propriétés moléculaires de ces polysaccharides à l’origine de leur efficacité et sélectivité d’action contre le développement de biofilms2 formés par des pathogènes bactériens. Les biofilms jouent un rôle important dans le bon fonctionnement des écosystèmes. A l’origine d’infection nosocomiales3 et chroniques, ces biofilms bactériens accélèrent néanmoins la dégradation des matériaux qu’ils colonisent, détériorent les canalisations d’eau potable et la qualité de l’eau et sont à l’origine d’infections alimentaires.
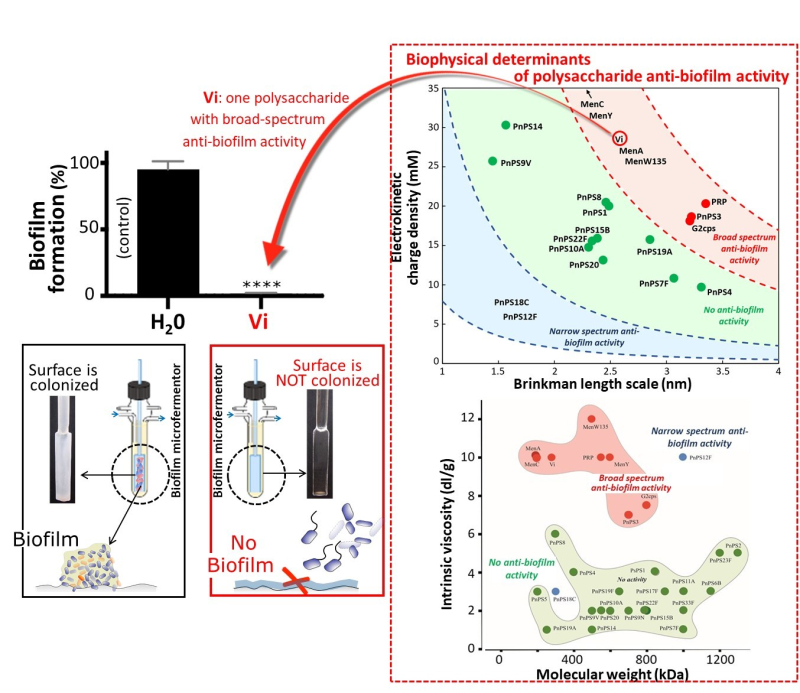
Les résultats de l’étude ont démontré un degré de sélectivité remarquable du spectre d’action antibiofilm (large, réduit ou absence d’activité) de polysaccharides capsulaires contre un panel d’espèces bactériennes pathogènes. Ces résultats, obtenus par des tests d’activité non-biocide4 et différents essais d’inhibition/formation de biofilms, ont été complétés par des analyses physicochimiques et biochimiques5 mettant en lumière une corrélation étroite entre spécificité d’action anti-biofilm de ces macromolécules, et leurs caractéristiques viscométriques et électrohydrodynamiques6 . Cette découverte a permis l’identification de nouvelles macromolécules polysaccharidiques ayant un large spectre d’activité anti-biofilm, y compris envers certains pathogènes nosocomiaux comme Escherichia coli et Staphylocoque aureus. L’étude ouvre ainsi la voie à de nouvelles perspectives quant à la conception de macromolécules non-biocides pour un contrôle des biofilms bactériens dans les environnements industriels et médicaux, ainsi que la lutte contre les infections nosocomiales et l’antibiorésistance.
- 1Les polysaccharides sont des glucides complexes constitués de sucres simples reliés entre eux par des liaisons glycosidiques.
- 2Les biofilms bactériens sont des amas pouvant se former sur les surfaces.
- 3Due à la ventilation artificielle ou à la contamination de matériels chirurgicaux en milieux hospitalier.
- 4Tests visant à établir l’activité non-biocide (qui ne tue pas, ici, les bactéries) des polysaccharides.
- 5Microélectrophorèse, SEC-HPLC, HPAEC-PAD, spectroscopie RMN, AFM, mesures d’angle de contact.
- 6Viscosimétrique : qui se rapporte à la viscosité, aux propriétés visqueuses des polysaccharides capsulaires. Electrohydrodynamique : qui se rapporte aux propriétés électrostatiques et hydrodynamiques des polysaccharides capsulaires lorsque soumis à un champ électrique en solution aqueuse.
Légende
Classification de polysaccharides bactériens capsulaires selon leur activité anti-biofilm en fonction de leurs propriétés électrocinétiques et viscosimétriques (spectre d’action large: zone rouge dans les deux panels de droite; spectre d’action réduite: zone bleue ; pas d’action: zone verte). © Référence.
Laboratoires impliqués
Laboratoires CNRS :
Laboratoire Interdisciplinaire des Environnements Continentaux (LIEC - OTELO)
Tutelles : CNRS / Université de Lorraine.
Institut Pasteur Université Paris Cité, CNRS UMR 6047, Genetics of Biofilms laboratory, Paris F-75015, France.
Autres laboratoires impliqués :
Institut Pasteur, Université Paris Cité, Inserm U1224, Brain-Immune Communication group, F-75015 Paris, France.
Institut Pasteur, Université Paris Cité, INRAE, USC2019, Fungal Biology and Pathogenicity laboratory, F-75015 Paris, France.
Sanofi, Research & Development, Campus Mérieux, 1541 avenue Marcel Mérieux, 69280, Marcy l'Etoile, France.
Pour en savoir plus
Bacterial capsular polysaccharides with antibiofilm activity share common biophysical and electrokinetic properties. Joaquín Bernal-Bayard, Jérôme Thiebaud, Marina Brossaud, Audrey Beaussart, Céline Caillet, Yves Waldvogel, Laetitia Travier, Sylvie Létoffé, Thierry Fontaine, Bachra Rokbi, Philippe Talaga, Christophe Beloin, Noëlle Mistretta, Jérôme F.L. Duval and Jean-Marc Ghigo. Nature communications 14, 2553 (2023).